Un team di ricercatori del Jpl della Nasa ha analizzato cinque ceppi del batterio Enterobacter isolati da tamponi prelevati, nel marzo del 2015, dalla toilette e dalla palestra della Stazione spaziale internazionale (Iss). Lo studio è parte di programma teso a caratterizzare le comunità batteriche che vivono sulle superfici all’interno della Iss. Dopo aver isolato 105 ceppi da varie superfici, utilizzando tecniche di coltura batterica e di biologia molecolare i ricercatori hanno prima cercato di dare un nome a questi batteri, e infine valutato la loro resistenza agli antibiotici, la resistenza multipla ai farmaci, la potenziale virulenza e la loro patogenicità.
Vi starete chiedendo: perché proprio sulla Stazione spaziale? Presto detto: la Iss, che proprio pochi giorni fa ha festeggiato il 20esimo anniversario, essendo un ambiente rigorosamente controllato e costantemente monitorato (flusso d’aria sotto pressione, circolazione dell’acqua e umidità), spazialmente isolato da qualsiasi altro ambiente, rappresenta un luogo interessante in cui fare ricerca scientifica, soprattutto in campo biomedico. Ricerche che comprendono studi sulle dinamiche delle comunità batteriche, gli effetti che la microgravità e il viaggio spaziale a lungo termine hanno sui batteri in orbita e le interazioni di questi batteri con altri microbi e con gli stessi astronauti.
Se ora state pensando a quale possa essere l’importanza di questo filone di ricerca, sappiate che, come sulla Terra, anche nello spazio questi organismi possono provocare qualche problema. Dall’alterazione dell’integrità strutturale di componenti della stazione, dovuta, per esempio, alla produzione di biofilm – come quelli della placca dentaria, per intenderci – fino ai rischi, non secondari, per la salute dei nostri astronauti. Perché, anche se in partenza forti e robusti, con un sistema immunitario da fare invidia a Capitan America, è stato dimostrato che la microgravità può compromettere il loro sistema immunitario. Non solo: la microgravità sembra anche rendere alcuni batteri virulenti e resistenti – o più virulenti e più resistenti agli antibiotici di quanto già non lo siano. Gli antibiotici, quindi, sebbene siano la strategia di trattamento primaria per combattere le infezioni, potrebbero non bastare sulla Stazione spaziale, o sulle future missioni nello spazio. Da alcuni studi è emerso come alcuni organismi diventino meno suscettibili all’azione antibiotica quando esposti al volo spaziale. Una maggiore resistenza agli antibiotici, la cui insorgenza non è ancora chiara, è stata osservata in diverse missioni. Potrebbe essere dovuta a un aumento delle mutazioni nei geni batterici. Studi che confrontano la sequenza della basi del Dna di batteri coltivati sulla stazione con quella quello di batteri coltivati sulla Terra, per esempio, hanno mostrato una frequenza 24 volte maggiore di mutazioni dei geni responsabili di questa resistenza in quelli coltivati sulla Iss. Per questi motivi c’è uno sforzo concertato per esaminare il microbioma – l’insieme di tutti i batteri – che popola la stazione attraverso studi di caratterizzazione.

La navetta spaziale Dragon SpaceX di ritorno dalla Stazione Spaziale Internazionale. Crediti: Nasa/Jpl-Caltech
Ma cos’è stato fatto in particolare in questo studio? Quali sono stati i passi che hanno portato a identificare questi batteri? Tutto comincia sulla Stazione spaziale, a circa 400km dalla terra. Lì, utilizzando dei tamponi o salviettine di campionamento, strofinandole sulle superfici prescelte, gli astronauti hanno innanzitutto raccolto i batteri presenti. A questo punto, tutti i tamponi raccolti sono stati messi in una borsa sterile con chiusura zip e inviati sulla Terra con la capsula space X Dragon. Trasportati all’interno del Jet Propulsion Laboratory (Jpl) della Nasa, ciascun tampone è stato prelevato dalla busta e trasferito in appositi contenitori per ottenere le cosiddette colture in sospensione, cioè batteri fluttuanti in un mezzo liquido. Questi batteri sono stati successivamente seminati, così si dice, cioè trasferiti su un supporto solido, come una piastra Petri, contenente un terreno nel quale avviene la loro crescita. Idealmente, se pensate che in sospensione vi fossero cento batteri, tutti diversi, ovviamente invisibili, quando seminati, ciascuno produrrà cloni di se stesso che potete osservare a occhio nudo come una colonia. Alla fine, quello che hanno ottenuto i ricercatori dopo questa procedura è l’isolamento di 105 colonie batteriche.
Da qui in poi inizia la fase di identificazione del batterio. Per ciascuna delle colonie, dopo avere rotto le membrane cellulari batteriche – l’involucro esterno – viene estratto il Dna ed effettuata l’analisi del gene che codifica per l’rRna 16S. Non temete, niente di complicato: questo gene, nei batteri di una stessa specie, tende a conservarsi nel corso dell’evoluzione, per cui, conoscendo la sua sequenza, cioè la lettura delle singole basi che lo costituiscono, e confrontando questa sequenza con quella di specie note, è possibile sapere univocamente, o quasi, di quale batterio si tratti: è una sorta di impronta digitale condivisa da tutti i membri della stessa specie. Queste analisi, seguite dal sequenziamento genomico (la lettura delle singole basi che costituiscono tutta la nostra informazione genetica) e dalla comparazione di questa lettura con quella dei genomi di 1291 batteri presenti in banche dati, ha permesso ai ricercatori di individuare tutte le 105 specie isolate, 5 delle quali erano molto simili al batterio Enterobacter bugandensis: una specie nuova, identificata per la prima volta nel 2016. Una specie patogena per l’uomo, conosciuta per causare infezioni ospedaliere.
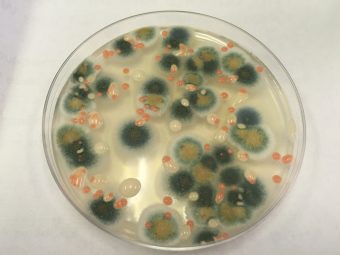
Coltura di microorganismi su piastra Petri. Crediti: Nasa/Jpl-Caltech
L’ultima parte della ricerca ha riguardato invece studi sulla antibiotico-resistenza e sulla resistenza multifarmaco di questi batteri. Due meccanismi diversi, per quanto riguarda il meccanismo molecolare alla base, ma che producono un risultato uguale: i batteri diventano insensibili a qualsiasi sostanza che noi umani utilizziamo per ucciderli. Nel primo caso, i batteri, acquisendo geni nuovi o modificando quelli che già possiedono, producono proteine capaci di inattivare gli antibiotici, rendendoli quindi inefficaci. Nel secondo caso, invece, le nuove proteine sono canali sulla membrana che “sputano” fuori il farmaco dal batterio. Da queste analisi, quello che i ricercatori hanno trovato è proprio una resistenza funzionale antimicrobica: informazioni rilevanti per le future missioni e la salute dell’equipaggio. In particolare sono stati identificati 112 geni coinvolti nella virulenza, nella resistenza agli antibiotici e nella resistenza multipla ai farmaci.
I ceppi di E. bugandensis identificati sulla Stazione spaziale, dunque, sebbene non patogeni per gli esseri umani, potrebbero comunque rivelarsi potenzialmente pericolosi. Una minaccia, concludono gli autori, da approfondire con esperimenti in vivo, prima di fare qualsiasi ipotesi sul fatto che l’acquisizione dell’antibiotico-resistenza e della resistenza multipla ai farmaci sia dovuta a cambiamenti durante il volo spaziale.
Per saperne di più:
- Leggi su Bmc Microbiology l’articolo “Multi-drug resistant Enterobacter bugandensis species isolated from the International Space Station and comparative genomic analyses with human pathogenic strains“, di Nitin K. Singh, Daniela Bezdan, Aleksandra Checinska Sielaff, Kevin Wheeler, Christopher E. Mason e Kasthuri Venkateswaran
Tour guidato nella toilette della Stazione spaziale, con Samantha Cristoforetti:







